公告
| 項 目 標 題 | 公告日期 | |
| 1 |
自即日起,調整臨床試驗委託者到院監測相關規定: 因應國內COVID-19疫情,調整廠商人員(CRA)入院規定如下,疫情期間將視情況作滾動式調整,請務必配合,感恩!
|
2022.04.25 |
| 2 | 自即日起,調整臨床試驗委託者到院監測相關規定。 | 2022.04.14 |
| 3 | 自即日起,因應藥品管理費加收10%院方管理費,新案採用新版「廠商委託研究計畫經費編列表暨部門配合表」。 | 2022.01.04 |
| 4 | 自即日起,因應討論合約條文召開視訊會議之需求,新增視訊會議出席費,並採用新版繳費單。 | 2021.07.26 |
| 5 | 自2021年5月1日起,調整臨床試驗合約審查費,並採用新版繳費申請單。 | 2021.04.26 |
| 6 | 自即日起,調整新案申請需備資料。 | 2021.04.26 |
| 7 | 自即日起,「計畫款」繳款,請提供Invoice,並採用新繳款單。 | 2021.04.26 |
| 8 | 2020年1月1日起,因應財政部規定,廠商委託計畫之補助款將加收5%營業稅並開立發票,如有相關問題請洽本院財務室。 | 2020.01.01 |
前言
「臨床試驗」
臨床試驗是要瞭解並證明新藥物或新治療方式的療效和安全性而在人體執行的研究,研究的目的是為了找到更好的治療疾病的方式讓每一位病患接得到更好的治療成果。
醫學及科學的進步,都是新點子及新方法經由研究發展而來的結果。這些新的治療在應用於病人之前,必須先在實驗室或動物小心地進行研究,找出成功機率最高的方法。但是實驗室的研究或動物研究並不能確保新療法在病人身上的反應,因為任何療法都可能有其療效、也可能有風險,甚至可能還有一些未知的反應或變化。所以新治療在被廣泛應用於臨床的常規治療之前,必須先按部就班地通過嚴謹的人體臨床試驗,用科學的方式證實其安全性及有效性,以便能找出更新、更好的治療來幫助每一位病患。參加臨床試驗的病患通常是最先使用新療法的人,因此也最有機會較早從新治療中獲益,這尤其對嚴重或是少見疾病的患者有很大的幫助。另一方面,所有參加臨床試驗的病患在試驗期間的一切醫療措施,都會受到事前的研究審查,後續執行也會在研究組織中仔細地監測,所以參加臨床試驗的病患往往可以得到更高品質的醫療照顧。
臨床試驗過程中的醫療行為,其臨床試驗主持人(醫師)皆會對受試者(參與試驗的病人或健康人)在參與臨床試驗之執行時可能面臨的各種問題(包含試驗的目的、試驗方法與過程、預期的不良反應及處理方法、預期效果、替代療法、試驗進行中的禁忌與限制...等),進行主動而充分的告知,並解答受試者所產生的任何疑惑。受試者在參與臨床試驗前,應對自身的權益做全面性的瞭解,並且清楚的了解到可能發生的不良反應甚至傷害和是否還有其他治療方法的選擇,確認清楚後才參加試驗。最重要的是,受試者有選擇是否參與臨床試驗的自由及權利,若決定不參與試驗或在參與後可不具理由在任何時間停止參與,醫師及醫院不會影響受試者日後就診及接受醫療照顧之權利。
或許您對臨床試驗感到陌生及好奇,或是曾有人邀請您參加臨床試驗,在您決定要參加以前,您應盡量對臨床試驗有所瞭解,除了特別注意試驗的可能風險(帶來的副作用、對生活會帶來的限制與改變、賠償內容機制...等),同時也須考量有無其他替代治療方法,請仔細衡量常規治療的已知效果與具風險的臨床試驗預期效果間之利弊,然後再決定是否參加臨床試驗。
目前本院多項新藥臨床試驗進行中,如果您想更進一步了解臨床試驗,您可詢問您的主治醫師或至床查詢本院目前進行中的試驗,以獲得進一步的資訊。
| 聯絡電話 | 03-8561825轉17602 吳 研究護理師 |
| 聯絡信箱 | Email住址會使用灌水程式保護機制。你需要啟動Javascript才能觀看它 |
| 聯絡地址: | 97002花蓮市中央路三段707號協力六樓602室 臨床試驗中心 |
| 意見信箱: | Email住址會使用灌水程式保護機制。你需要啟動Javascript才能觀看它 |
研究服務內容:
| 1.為廠商轉介適合之臨床試驗主持人/協同主持人 2.計畫經費預估 3.協助臨床試驗合約審查與加速簽署合約書進度 4.研究護理師人力支援 5.協調院內各單位配合研究案進行 6.協助臨床試驗執行與配合稽核 |
新案申請需備資料:
| 1.已審核通過之臨床試驗協議(合約)書 2.廠商委託研究計畫經費編列表暨部門配合表 3.試驗委託者授權書/委託書(如有委託CRO者需附) 4.研究倫理委員會許可書 5.衛生福利部核准函(如有需附) 6.臨床試驗計畫書 |
廠商委託計畫申請流程: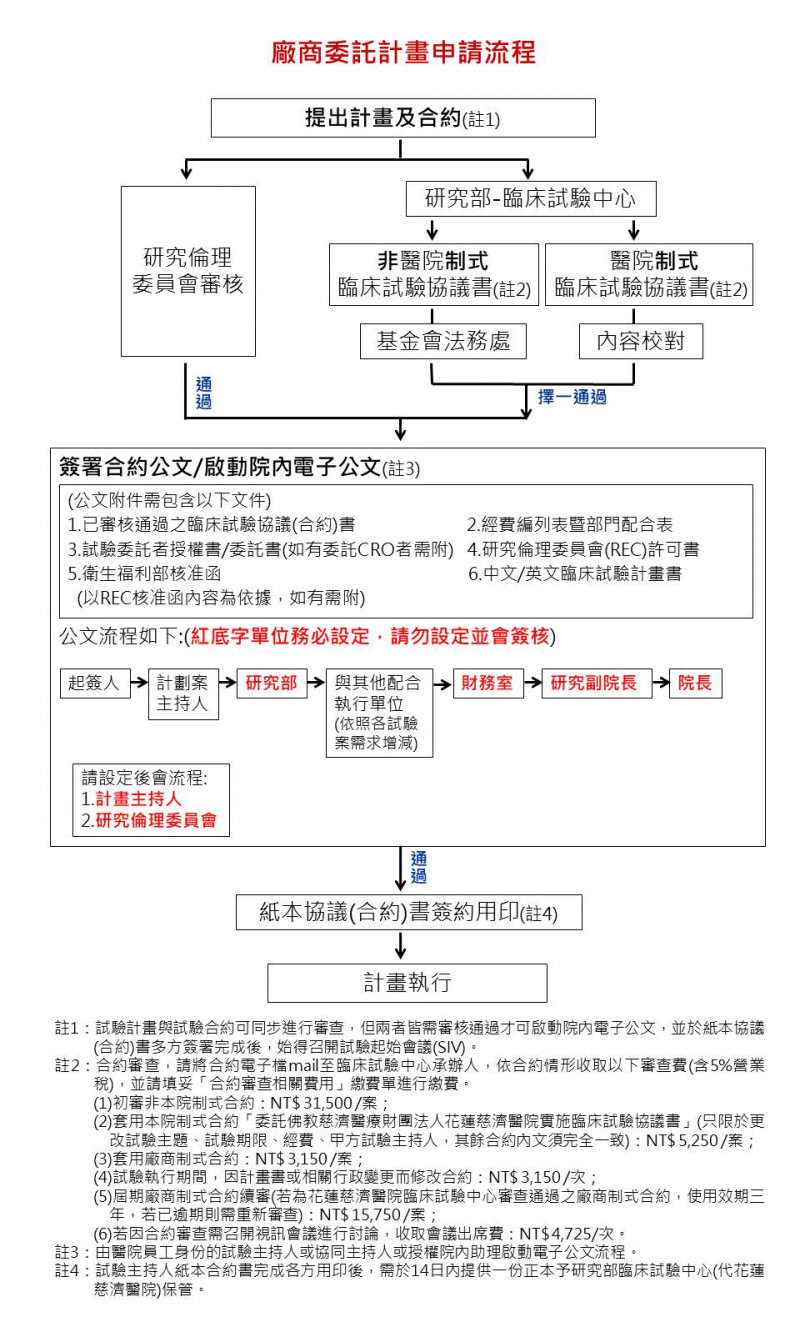
臨床試驗中心收費項目: 臨床試驗中心執行案件收費標準(準備中)
相關文件表單下載:
| 項 目 | 文 件 / 表 單 名 稱 | 更 新 日 期 |
| 新 案 申 請 | 委託佛教慈濟醫療財團法人花蓮慈濟醫院實施臨床試驗協議書 | 2018.01.12 |
| 廠商委託研究計畫經費編列表暨部門配合表 (新案申請須檢附) | 2022.01.04 | |
| 花蓮慈濟醫院或廠商制式合約編修表 (本院"制式"或廠商"制式"合約編修申請須檢附) | 2021.04.26 | |
試驗進行中相 關 申 請 |
臨床研究人員識別證與電子病歷權限申請表 (病歷借閱與電子病歷權限申請請洽本院病歷室或院內研究人員) |
停止辦理 |
| 病歷查閱保密同意書 | 依負責單位公告為主 | |
| 廠商委託計畫經費變更申請表 (試驗期間經費變更請填寫此表單,並同步更新"廠商委託研究計畫經費編列表暨部門配合表") | 2020.08.19 | |
| 廠商委託臨床試驗合約編修表 (試驗期間合約變更請填寫此表單,若經費有同步變更請一併檢附"廠商委託計畫經費變更申請表"和"廠商委託研究計畫經費編列表暨部門配合表") | 2018.03.16 | |
| 收 費 相 關 | 廠商委託研究計畫「合約審查相關費用」繳費單 | 2021.07.26 |
| 廠商委託「研究計畫經費」繳款單 | 2021.10.05 | |
| 臨床試驗藥品管理費繳費單(藥品管理費、非室溫藥品儲存費繳納後始接受相關訓練及收受並管理試驗用藥) | 依負責單位公告為主 | |
| 廠商委託計畫經費結算表(試驗結束經費退款需檢附) | 2021.01.22 | |
| 其 他 | 感染性生物材料或傳染病病人檢體新增、寄存、分讓申請同意書 | 依負責單位公告為主 |
| 檢驗醫學科『實驗室認證證書』影印本申請表 | 依負責單位公告為主 |
臨床試驗案件查詢: 花蓮慈濟醫院臨床試驗案
其他資訊參考網站 :
